Biocen, la estratégica etapa final en la fabricación de vacunas y otros productos de la biotecnología cubana
may 24th, 2021. En: COVID-19, NotiWeb. 0 comentarios. ![]()
 Creada en 1992, Biocen es una empresa de alta tecnología del grupo BioCubaFarma. Es la salida productiva de un número importante de productos de la biotecnología cubana, que en 2021 asumió las etapas de formulación y llenado de las vacunas Soberanas.
Creada en 1992, Biocen es una empresa de alta tecnología del grupo BioCubaFarma. Es la salida productiva de un número importante de productos de la biotecnología cubana, que en 2021 asumió las etapas de formulación y llenado de las vacunas Soberanas.
Cubadebate se acercó al desarrollo de estos procesos, y a una importante inversión y actualización tecnológica en su planta de ingredientes farmacéuticos activos.
El recorrido por el Centro Nacional de Biopreparados (Biocen), empresa de alta tecnología del grupo BioCubaFarma en Bejucal, Mayabeque, cerca de la periferia habanera, comienza en la Planta de Envase. En esta jornada están etiquetando y envasando la Soberana 02.
El itinerario partió del Centro de Inmunología Molecular, donde, en un fermentador, se cultiva en células de mamífero (CHO, derivadas de ovario de hámster chino) la proteína RBD del virus SARS-CoV-2. De ahí, pasa al Instituto Finlay de Vacunas (donde se concibió el inmunógeno) y se conjuga el RBD con −en el caso de la Soberana 02− el toxoide tetánico.
Ese ingrediente farmacéutico activo (IFA) conjugado se envía a Biocen, donde se realiza la formulación, el escalado productivo, y transcurre el proceso final hasta el envasado.
Ahí también, mientras envasan, las operarias revisan los bulbos en busca de la más mínima imperfección en el etiquetado. Es uno de los detalles en la industria biotecnológica y en Biocen: la revisión, el control de la calidad constante, desde el primer paso de fabricación hasta la liberación final de cada lote por la autoridad regulatoria para la distribución.
Lo apreciamos minutos después, en la Planta de Parenterales 2. Allí comenzamos el recorrido por la sala automatizada de control, donde se siguen en pantallas todas las áreas de producción y se monitorean los parámetros de la planta.
De IFA conjugado a vacuna
Se escucha o lee “formulación”, “llenado” o “escalado productivo” y todo puede parecer simple, pero llevar el IFA a producto final −algo que, como característica de la industria biofarmacéutica a nivel mundial, se hace en locaciones o plantas distintas, incluso de países distintos− requiere plataformas tecnológicas (tanto maquinaria como procesos de producción) muy avanzadas, know how y detallados y estrictos procesos de validación y auditoría permanentes.
Según datos de la industria, el antígeno de la vacuna Pfizer/BioNTech se fabrica en Misuri y el ARNm en Massachussets, mientras que la formulación y el envasado tienen sede en Michigan y Puurs (Bélgica). Este año, BioNTech abrió otra planta productiva en Marburgo (Alemania), pero igual el envasado se hace en Puurs.
Moderna usa plantas para producir antígenos en Nuevo Hampshire, Pensilvania y Suiza, y dos especializadas en acabado en España e Indiana. Un análisis reciente refería que la vacuna de AstraZeneca/Oxford se produce en 25 plantas distribuidas en todo el mundo.
Hay que sumar a eso que estas cadenas dependen de plantas o laboratorios que suministran lípidos, enzimas, material genético y otros componentes, tanto sustancias como implementos especializados empleados en la producción.
En abril, leímos sobre países latinoamericanos que producirían el IFA y asumirían el llenado de una de las vacunas disponibles en el mercado, por acuerdo con la compañía desarrolladora.
El dueño de uno de los laboratorios implicados, al explicar demoras en el llenado, publicó en Twitter que “envasar cada tipo de vacuna requiere una serie de equipos e insumos específicos que, por la alta demanda global, hoy resultan imposibles de conseguir rápidamente”. Hablaba también de la “capacitación del personal científico y técnico para esta fabricación en particular”, que implica “reentrenar personal y realizar nuevas inversiones”.
Además, puntualizaba que su compañía no puede disponer del principio activo como si le perteneciera, “porque no es la propietaria”, menos aún de la vacuna.
Es decir… Plataformas tecnológicas, equipos altamente especializados, know how, plantas con tecnología de punta; especialistas, técnicos y operarios bien capacitados. Todo acorde con regulaciones estrictas, validado y auditado nacional e internacionalmente y certificado por los reguladores sanitarios.
Igualmente, insumos y materiales específicos de alta demanda en un mercado tensionado por la crisis sanitaria y bajo presión de la competencia (por vacunas y componentes); desarrollo y producción en cadena (en lo que es una ventaja, en el caso de Cuba, el enfoque de cooperación, el conocimiento y los procesos compartidos entre centros de la isla) y, entre muchos otros, un detalle importante: la propiedad sobre el IFA y las vacunas. En Cuba, ambos son cubanos.
En el caso de las tres vacunas Soberana, el ciclo comienza en el Centro de Inmunología Molecular (CIM), continúa en el Instituto Finlay de Vacunas (IFV) y concluye en Biocen. Es una de las rutas tecnológicas de las vacunas cubanas; la otra, de Abdala y Mambisa, involucra al CIGB y los Laboratorios AICA.
En la sala de control, el jefe de las plantas de parenterales de Biocen (Parenterales 2 y Parenterales 3), el ingeniero y máster en Ciencias Humberto Pérez de la Concepción, comienza hablándonos de los estrictos protocolos que aseguran la calidad y seguridad de los procesos.
“El cuidado es extremo. El aire es filtrado, no puede haber partículas porque pueden contener microorganismos. Hay requisitos de vestuario y parámetros establecidos de humedad, temperatura, presión y niveles de partículas en el aire, que se mantienen en índices aceptables según las diferentes clasificaciones de áreas”, explica.
“En clase A, donde están las máquinas de llenado, el operario ingresa y trabaja con toda la anatomía cubierta, incluidos careta, doble traje de aislamiento y doble guante. No puede haber ninguna superficie del cuerpo expuesta, porque en cualquiera de estas áreas de producción el hombre es el mayor contaminante”.
“Luego está la clase B, un poco menos rigurosa. En las operaciones que se realizan el vial no está expuesto, pero es el área que rodea a la clase A; por lo tanto, debe estar controlada, al igual que los requisitos de vestimenta”.
Otra condición del ambiente interior en las plantas de parenterales es la presión. “La presión es positiva desde el lugar más limpio al más sucio o en condiciones ambientales más cercanas a lo normal; hay una cascada de presiones, cambios de presión de un ambiente a otro, para que el aire salga del lugar más controlado a los menos controlados, hasta el área en condiciones ambientales más cercanas a lo normal.
“Quienes trabajan ahí tienen sobrepresión, están sujetos a condiciones de trabajo irregulares. Tienen este sistema de ropa, que es incómodo, doble uniforme y doble guante los que están en grado A y grado B; careta y otros implementos. Son condiciones difíciles de trabajo.
“Debido a esto, lo máximo que pueden estar en un turno son cinco horas, es el más largo que tenemos. Esto en las clases A y B, las de producción”.
El sistema de presión también se controla en el puesto de control, donde hay un plano de toda la planta, con el sistema de cascada de presiones entre un ambiente y otro. Va pasando desde 10 o 15 pascales de diferencia hasta llegar al ambiente final. O sea, tenemos cuatro clases, puede que haya 60 pascales de diferencia entre el ambiente primario, el más controlado, y el ambiente exterior.
Los trabajadores pasan por chequeos médicos periódicos. No todo el mundo puede trabajar en área aséptica, no solo por la presión, sino también por las condiciones: parados, sometidos a estrés, con un vestuario especial; no pueden salir en turnos de 4 o 5 horas, porque una salida puede implicar una parada del proceso.
En las otras clases, C y D, el área de preparación, se alistan los materiales que pasan al área de producción (formulación y llenado) a través de dispositivos y procesos de esterilización.
“Todo lo que entra al núcleo, el área donde se encuentran las máquinas llenadoras, donde puede estar expuesto el medicamento, tiene que estar estéril”, señala el jefe de las plantas de parenterales de Biocen mientras nos muestra en las pantallas de control las diferentes áreas, donde se ve a los operarios en sus funciones.
Por un lado, tapones y sellos pasan por autoclaves de doble puerta conectadas al área más limpia o crítica. “La autoclave descarga en el área limpia, bajo flujo laminar se recibe lo que ya está estéril, se guarda en esas condiciones y se traslada a las áreas de producción”.
Cuando accedemos −debidamente vestidos− al área de recepción de bulbos ya llenados, vemos en acción, del otro lado del cristal, la máquina llenadora, con los depósitos de tapones y sellos de aluminio, y los viales ingresando por una plataforma móvil desde el horno.
“Los viales transitan por un proceso de lavado para remover cualquier partícula en el interior o exterior, y después por uno de despirogenización (esterilización por calor seco) en un horno que alcanza los 300 grados. Desde ahí ingresan al área aséptica para alimentar la máquina llenadora, que dispensa el producto en cada vial, según las especificaciones, a partir de un contenedor”, nos dice Pérez.
Ese contenedor llega desde otra parte del área crítica o de producción: la de formulación. En esta funciona un sistema de tanques rígidos y otro de bolsas tipo tanque, desechables, de 50 litros. “El medicamento ya formulado pasa de los reactores o del recipiente donde se realice la formulación a esa bolsa, que luego se conecta a la llenadora −que también recibe viales, tapones y sellos−, y de la máquina salen ya llenos y listos los viales a la inspección visual, el etiquetado y envasado”.
En la Planta de Parenterales 2 funcionan dos máquinas llenadoras con capacidad para 7 000 viales por hora cada una (14 000/hora en total). En Parenterales 3 hay también dos máquinas, una de 12 000 y otra de 4 000 (16 000/hora en total).
Pérez precisa que la Planta de Parenterales 3 está dedicada “a liofilizados y otros productos biológicos o biotecnológicos, principalmente de los centros a lo que damos servicio: el Centro de Ingeniería Genética y Biotecnología (CIGB), el CIM, el IFV y también otros como el Censa, en el caso del Surfacén. La línea de 4 000 se usa para liofilizados, que tienen menor volumen en cuanto a tamaño de lote. La de 12 000, para otros productos con mayor volumen de producción, como, por ejemplo, la eritropoyetina recombinante del CIM”.
En Parenterales 2, las dos líneas de 7 000 son destinadas principalmente a vacunas, “entre ellas las vacunas contra la hepatitis, contra el tétanos y ahora contra la COVID-19”.
Parenterales 3 está diseñada para procesar dos productos a la vez, pues las dos líneas son paralelas, cada una con su preparación de materiales, su formulación y su sistema de llenado. En Parenterales 2, un solo producto a la vez, pues las dos máquinas llenadoras son servidas por las mismas áreas de preparación de materiales y de formulación.
El día de nuestra visita, en las dos plantas de parenterales de Biocen se llenaba Biomodulina T (de Biocen, un inmunomodulador que está entre los medicamentos empleados en el tratamiento de enfermos de COVID-19), eritropoyetina recombinante (ior ® EPOCIM, del CIM, para el tratamiento de anemia en pacientes con insuficiencia renal crónica, sida, bajo quimioterapia, entre otros), y el medio de transporte para hisopos (BTV, también de Biocen, actualmente destinado a la recolección y el traslado de muestras clínicas a los laboratorios de biología molecular para el diagnóstico confirmatorio por rt-PCR de COVID-19).
De la formulación y el llenado, en el área de producción, los viales pasan a la inspección visual en tres modalidades: manual, semiautomática y automática.
“El ciento por ciento de las unidades tiene que pasar por la inspección visual, en la cual se detecta si el vial tiene el contenido correcto, la apariencia requerida (no puede tener un objeto extraño o un color diferente al que establece la especificación del producto) y otros aspectos más cosméticos, como que el retape del vial esté bien colocado. El vial no puede tener la más mínima ralladura”.
En términos de tiempo, Pérez precisa que la formulación se realiza un día antes o en la madrugada anterior al llenado. Depende del producto, de la cantidad de componentes y las condiciones en que se añade cada uno de esos componentes.
La cadena de procesos previos al llenado de un producto farmacéutico es compleja. “Primero hay que preparar los reactores, los materiales, las soluciones, los componentes activos de la formulación, pero hay excipientes que también hay que preparar, esterilizar y adicionar. Se incluyen el buffer (tampón, solución amortiguadora o reguladora, que mantiene estable el pH); si lo lleva, también preservo, que se prepara y se adiciona al final para asegurar la esterilidad del producto en el vial. Por ejemplo, el tiomersal que se usa en nuestras vacunas cuando son multidosis”.
El de Soberana 02 “es un proceso rápido, pues tiene pocos componentes”. Desde que se preparan los materiales y equipos, toma alrededor de 48 horas.
“Aquí recibimos el ingrediente farmacéutico activo y realizamos el proceso de formulación, que consiste en mezclar ese IFA con los otros componentes o excipientes que contiene la vacuna, en una concentración determinada. Ahí están las sales, un buffer, fosfato, que mantiene el pH en un rango determinado, y, si es presentación multidosis, el preservo, en este caso el tiomersal”.
Cada uno de los reactores pasa por un proceso automático previo de lavado y esterilización. “Cuando están estériles, comenzamos a preparar los componentes de la vacuna, que se mezclan en un orden determinado de adición y a una velocidad específica. Eso da lugar a la vacuna formulada, que le llamamos ‘a granel’ y que se traslada en las bolsas desechables hacia el área de llenado. Estas se conectan a la máquina, que dispensa el producto en los viales, según el volumen programado”.
“Hay que tomar en cuenta que el proceso de llenado tiene una preparación previa: el montaje de todos los componentes de la línea de llenado que tienen que ingresar estériles al área, la conexión del producto a granel a la máquina de llenado, que también tiene su proceso y su procedimiento establecido; el monitoreo del área, el control previo al llenado, el ajuste previo del volumen a dispensar…
Todas estas son operaciones de rutina antes de cada llenado, e incluyen, después de que todo está listo, la revisión de especialistas y técnicos en el área, y un supervisor de buenas prácticas que garantiza que todas estas operaciones se realicen cumpliendo con lo regulado”.
“Todo −nos comenta el jefe de las plantas− transcurre en ambientes bajo monitoreo las 24 horas, tanto de partículas como de microorganismos. Los datos del monitoreo son registrados y guardados, porque esa información hay que enseñarla a la autoridad regulatoria o a cualquier auditor que, en cualquier momento, necesite comprobar en qué condiciones se hizo, por ejemplo, un lote específico de un producto específico”.
Durante el llenado se toman muestras de todo para comprobar la calidad, tanto microbiológica como físico-química; parámetros como pH, concentración, identidad, todo según la especificación de cada producto, y se envían al laboratorio de control de calidad de Biocen.
Además de una decena de inspecciones o auditorías anuales por parte de la autoridad regulatoria nacional, el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed), y clientes tanto internos para los que formulan y llenan (CIGB, CIM, IFV, entre otros) como extranjeros (aquellos que compran los productos de esos mismos centros, que son procesados en Biocen), el Centro Nacional de Biopreparados debe pasar por procesos de validación periódicos.
“Cada seis meses, por regulación, debemos realizar una simulación y validación del proceso. Para garantizar que lo que está ahí está estéril, tenemos que demostrarlo. Lo hacemos con el proceso productivo más crítico, el material de envase más crítico (que demore más tiempo y que tenga más posibilidades de contaminarse; no es lo mismo que entre un microorganismo en un vial unidosis que en uno multidosis, con una abertura mayor, en uno que tarda más en transitar por la línea de llenado que en uno que lo hace más rápido).
“Todo esto se tiene en cuenta. Tomamos un medio de cultivo (una solución enriquecida donde pueden crecer los microorganismos fácilmente), que es el más crítico, el más fácil de contaminarse, y se hace una corrida de llenado…. En esas condiciones se hace la validación, con los mismos operarios, simulando todas las intervenciones y fallos posibles, las paradas. Si en esas condiciones críticas la corrida de llenado sale estéril, tenemos la certeza de que con el producto, que es menos sensible a contaminación, todo va a estar bien”. [Por: Deny Extremera San Martín, Irene Pérez ]
Vea más en:
Comentar





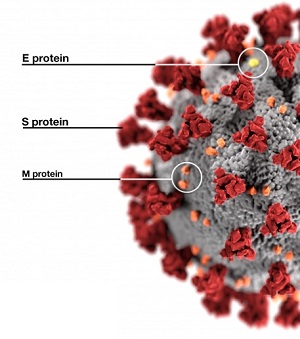
 Las infecciones provocadas por los coronavirus son comunes en todo el mundo y pueden afectar a personas y animales. En los humanos pueden causar el catarro común y la gastroenteritis en lactantes. Existen varios tipos de coronavirus y aunque por lo general ocasionan enfermedades leves o moderadas, también pueden estar implicados en procesos graves...
Las infecciones provocadas por los coronavirus son comunes en todo el mundo y pueden afectar a personas y animales. En los humanos pueden causar el catarro común y la gastroenteritis en lactantes. Existen varios tipos de coronavirus y aunque por lo general ocasionan enfermedades leves o moderadas, también pueden estar implicados en procesos graves... 



Comentarios realizados
Adrik @ 12:10 pm
Soy bejucaleño y estoy orgulloso del trabajo realizado en el BioCen y de su comunidad científica. Sigan así