Cuba se une a la celebración por el Día Internacional del Ensayo Clínico
 La pandemia de la COVID-19 provocó que la comunidad científica centrara sus esfuerzos en el desarrollo de medicamentos y vacunas para cortar la transmisión del SARS-CoV-2 y sus efectos sobre la salud humana. Tras esos empeños de la ciencia las personas también han adquirido conocimientos y términos que para muchos eran desconocidos, entre ellos el de ensayo clínico.
La pandemia de la COVID-19 provocó que la comunidad científica centrara sus esfuerzos en el desarrollo de medicamentos y vacunas para cortar la transmisión del SARS-CoV-2 y sus efectos sobre la salud humana. Tras esos empeños de la ciencia las personas también han adquirido conocimientos y términos que para muchos eran desconocidos, entre ellos el de ensayo clínico.
Sin embargo, cada 20 de mayo, desde 2005, los científicos de todo el mundo celebran el Día Internacional del Ensayo Clínico, con el objetivo de dar a conocer al público en qué consiste la labor científica detrás de una vacuna o un medicamento para una enfermedad concreta.
La fecha alude al primer ensayo clínico de la historia, realizado por el doctor escocés James Lind en 1747, que sentó las bases para la investigación clínica al tratar de identificar la ausencia de la vitamina C como causa del escorbuto que afectaba a los marineros de la Armada Británica.
A pesar de la presencia del nuevo coronavirus en Cuba, el Centro Nacional Coordinador de Ensayos Clínicos (CENCEC), subordinado al Ministerio de Salud Pública (MINSAP), participa del control, diseño y conducción de los 105 ensayos que actualmente se desarrollan en todo el territorio nacional, de ellos, 43 están destinados al tratamiento del cáncer.
Con respecto a la COVID-19, desde marzo de 2020 al 20 de abril de 2021, la máxima dirección del MINSAP aprobó 28 ensayos clínicos para prevenir y tratar la enfermedad, de ellos cuatro terminaron en el 2020 y 24 se encuentran en algunas de sus etapas de desarrollo; un proceso que puede durar unos 10 o 12 años entre las diferentes etapas y su administración a escala poblacional.
De igual forma, se han registrado 46 estudios –no todos ensayos clínicos– para tratar el virus, 14 de ellos pertenecen al Centro de Ingeniería Genética y Biotecnología y 10 al Instituto Finlay de Vacunas, y en unos 22 tiene participación el CENCEC.
¿Qué es un ensayo clínico?
Un ensayo clínico es una metodología de investigación que se realiza con la participación de seres humanos como voluntarios, para evaluar el efecto de una intervención de medicamentos, equipos o dispositivos médicos en un problema de salud concreto.
A este se llega una vez vencidos los estudios preclínicos (de farmacología y toxicología) en células y luego en animales de laboratorio, los de formulación y estabilidad del producto farmacéutico, a partir de las regulaciones establecidas, explicó Yamilé Cachimaille Benavides, jefa del departamento de ensayos clínicos del CENCEC.
Esos resultados se presentan a la autoridad reguladora, el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), para iniciar el ensayo clínico, aunque no es suficiente con un solo estudio para completar el desarrollo clínico de un producto farmacéutico, sino que se necesitan de varios y ahí es donde intervienen las fases.
La primera fase busca evaluar la seguridad del producto, identificar reacciones adversas y si son tolerables o no por los seres humanos, es decir, evaluar los posibles riesgos. Para la segunda fase se estudia el efecto (respuesta inmune en el caso de vacunas), las dosis y los eventos adversos, o sea, la seguridad, que está presente en todo momento. En cuanto a la tercera, se enfoca en la eficacia clínica y se solicita el registro sanitario del medicamento; mientras que en la cuarta fase (pos registro) se persigue la efectividad.
Cachimaille Benavides señaló que cada momento de la investigación se diferencia en cuanto a la cantidad de personas que se exponen, al inicio son menos y más homogéneos, luego la muestra es mayor y más heterogénea. A medida que avanzan las fases también las condiciones son menos experimentales, con criterios de selección muy restringidos al principio y más flexibles después, acorde con la seguridad demostrada.
¿Cuándo el CECMED aprueba un ensayo clínico?
Detrás de la aprobación de un fármaco, ya sean medicamentos, productos biológicos, biotecnológicos, naturales u homeopáticos, además de equipos y dispositivos médicos existe un proceso estricto de evaluación, con la presentación de la documentación necesaria al CECMED y la revisión del producto, teniendo en cuenta los estudios preclínicos realizados en animales y toda la información de los ensayos clínicos realizados, expresó la Máster en Ciencias Olga Lidia Jacobo Casanueva, directora de la institución.
Acerca del proceso, detalló que lo primero es cumplir los requisitos implementados en la Regulación 21 de 2008 del centro donde se establece que el protocolo clínico debe ser revisado y avalado por un Comité de Ética en la Investigación Clínica, organización independiente integrada por profesionales, médicos y científicos cuya responsabilidad es asegurar la protección de los derechos, la seguridad y el bienestar de los seres humanos involucrados en un estudio.
De igual forma, constituyen requerimientos la aprobación del MINSAP, como órgano rector de las investigaciones clínicas en el país, y la inscripción en el Registro Público Cubano de ensayos clínicos, actividad que le corresponde al CENCEC.
El expediente a presentar debe contener básicamente toda la información relacionada con el desarrollo del candidato vacunal, proceso de producción, controles y especificaciones de calidad, formulación de la vacuna, composición, fabricación de lotes y estabilidad.
Asimismo, incluye la información referida a los estudios toxicológicos en animales, estudios de dosis y los farmacológicos, así como los detalles vinculados al protocolo clínico relacionados con el diseño, selección de los sujetos, objetivos del estudio, sitios clínicos participantes, esquema de tratamiento, eventos adversos, variables a controlar, recolección de la información y manejo de datos, entre otros aspectos, explicó Jacobo Casanueva.
Insistió en que una vez registrado el producto, la labor del CECMED no queda ahí, sino que se mantiene la vigilancia en el mercado para saber cuál es su comportamiento. Si aparece algún evento adverso o en el caso de que presente una falla de calidad puede investigar, tomar muestras y hacer un dictamen, además tienen la potestad para retirar cualquier lote.
Tanto el CENCEC como el CECMED y el MINSAP trabajan día a día por implementar ensayos clínicos de calidad, que tributen a resultados investigativos favorables y novedosos en aras de contribuir a una mejor salud del pueblo cubano. En el Día Internacional del Ensayo Clínico llegue la felicitación y reconocimiento a todos los profesionales cubanos que dedican su labor a la realización de estas investigaciones.
Tomado de: Minsap – 20 mayo 2021
Comentar





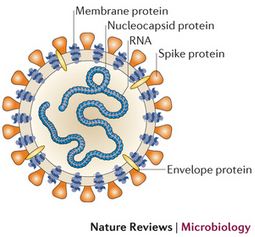
 Las infecciones provocadas por los coronavirus son comunes en todo el mundo y pueden afectar a personas y animales. En los humanos pueden causar el catarro común y la gastroenteritis en lactantes. Existen varios tipos de coronavirus y aunque por lo general ocasionan enfermedades leves o moderadas, también pueden estar implicados en procesos graves...
Las infecciones provocadas por los coronavirus son comunes en todo el mundo y pueden afectar a personas y animales. En los humanos pueden causar el catarro común y la gastroenteritis en lactantes. Existen varios tipos de coronavirus y aunque por lo general ocasionan enfermedades leves o moderadas, también pueden estar implicados en procesos graves... 


Comentarios realizados
Vian Valdez @ 2:19 pm
Saludos. Trato de ser breve. Participé voluntariamente en los ensayos de Soberana 02 después de aceptar toda la información dada al respecto, ayer fui a ponerme la 3ra. dosis y resultó que caí en el grupo de placebo. Fue un riesgo que conciente corrí, pero por qué ahí mismo no me pusieron en ese momento la 1ra. dosis del candidato vacunal y debo esperar la vacunación masiva si en ese grupo está lista toda mi información. Me agradaría una respuesta. Gracias anticipadas.
Tania Izquierdo Pamias @ 4:09 pm
@Vian Valdez: A ver, la vacunación a los grupos placebo va a comenzar en breve. Antes que la vacunación masiva. Lo informaron ayer en la Mesa Redonda. No se les puso la vacuna en el momento de la tercera dosis por alguna razón organizativa que yo no le puedo explicar porque la desconozco. Pero la hay, no tenga usted dudas. Solo un poco de pacienica; serán priorizados dentro de la población.
yuneisy @ 11:47 pm
el siete de junio comienza la vacunación al grupo placebo,lo oí en mesa redonda