| GEOFFREY ROBB, Otorrinolaringólogo y cirujano plástico en el centro MD Anderson de Houston, en Texas, es uno de los líderes mundiales en reconstrucción mamaria.
MARÍA VALERIO-16 de Julio de 2009-EL MUNDO Geoffrey Robb es uno de los líderes en la cirugía de reconstrucción de la mama, una cuestión que va más allá de la estética en las mujeres con cáncer. Su último empeño es utilizar tejidos de la propia paciente para lograr un mejor resultado. Pregunta.- ¿Cuáles son los últimos avances para reconstruir el pecho tras una mastectomía? Respuesta.- Estamos intentando utilizar tejido de la propia paciente, empleando piel y grasa abdominal. Hace unos años, se implantaba también músculo del abdomen, pero, en la última década, estamos aprendiendo a separar estos músculos, apartarlos sin dañarlos y quedarnos sólo con la vasculatura, la piel y el tejido graso. Porque al quitar la musculatura teníamos cierto riesgo de provocar deformidades, o una hernia, y cierta debilidad en esa zona. P.- ¿Qué ventajas tiene utilizar tejidos propios en lugar de implantes artificiales? R.- La mayoría de mujeres en todo el mundo prefiere tener un pecho de su propio tejido, porque [este material] es el mejor sustituto al tejido natural. Virtualmente va a ser idéntico, va a tener un tacto y una apariencia idéntica a los de la mama original. Eso es lo que quieren y también es más fácil obtener simetría con respecto al otro pecho sano. P.- ¿Esta técnica es válida tanto para mastectomías radicales como para cirugías conservadoras? R.- Algunos cirujanos también emplean el tejido abdominal cuando quieren reconstruir la mama después de una tumorectomía o cuadrantectomía [que consiste en extirpar sólo la porción del pecho donde está el tumor]. Sin embargo, yo soy partidario de ‘reservar’ esta fuente para las mastectomías radicales [extirpación completa de la glándula mamaria], porque, si ya lo has utilizado para una reconstrucción parcial y la mujer vuelve a sufrir una recaída en unos años, puedes necesitarlo. Otras zonas de donde se puede extraer tejido propio con este fin son la nalga o la cara interna del muslo. P.- ¿Se está trabajando también con células madre en este campo de la reconstrucción? R.- Sí, todo el mundo está tratando de comprobar si son seguras, si su uso no va a causar problemas. Aunque sabemos que no aumentan el riesgo de cáncer, uno de los riesgos que sí estamos viendo es que los implantes de grasa (donde hay tanto células madre como adipocitos ya diferenciados) pueden causar calcificaciones en la mama. Y aunque, en general, un radiólogo puede ver la diferencia entre estas células grasas, que no son capaces de sobrevivir en la mama y se calcifican, o una microcalcificación natural [un posible indicador precoz del cáncer de mama], a veces es necesario hacer una biopsia para confirmarlo. Así que hay que tener cuidado y los cirujanos deben actuar con responsabilidad. P.- ¿Y están tratando de separar y cultivar las células madre propiamente dichas para implantarlas solas? R.- Sí, se está haciendo en el campo de la investigación, tratando de cultivar y expandir esa población de células madre que hay en la grasa, mezcladas con otras ya diferenciadas. Hoy por hoy, no sabemos con seguridad quién está ‘haciendo el trabajo’, si son ellas o son las células de la grasa propiamente dichas. La investigación nos está dando cada día más evidencias concluyentes de que se trata de las células madre, pero es posible que se deba a su combinación con las ordinarias. Por eso tenemos que vigilar estrechamente y documentar bien la evolución de la mama. P.- ¿Estas técnicas supondrán el final de los implantes artificiales? R.- Desde luego creo que en el futuro veremos un menor uso de estas prótesis. Usaremos implantes más pequeños o bien recurriremos a ellos en aquellos casos en los que no haya sido posible hacer un autotrasplante con tejido de la propia paciente. Por ahora, tanto la investigación como la experiencia clínica nos están demostrando que el uso de tejido propio es seguro y no plantea problemas de rechazo. |
En: Noticias ![]()
Identifican un grupo de células cardiovasculares que dan lugar a las principales células del corazón
Según los autores del descubrimiento, estas células pueden cultivarse en el laboratorio y podrían fomentar el conocimiento sobre el desarrollo y las enfermedades cardiovasculares así como ser útiles en la medicina regenerativa cardiovascular.
Las células progenitoras, aisladas de corazones fetales humanos, pueden dar lugar a células musculares cardiacas estriadas y del músculo liso así como a células endoteliales.
Los científicos, dirigidos por Kenneth Chien, utilizaron dos métodos independientes, transgénico y dirigido a los genes, en líneas de células madre embrionarias humanas para mostrar que las poblaciones purificadas de estas células pueden autorenovarse y expandirse antes de la diferenciación en tipos de células más maduras.
Noticia mas completa en Inglés
Researchers in Massachusetts have identified the earliest master human heart stem cell from human embryonic stem cells – ISL1+ progenitors – that give rise to a family of cells that form the essential portions of the human heart.The discovery, by Harvard Stem Cell Institute researchers at Massachusetts General Hospital led by Kenneth Chien, is particularly important because the cells were found in regions of the heart known as hot spots for congenital heart disease.
These latest findings build upon and expand earlier work by Chien’s team and others in mice.
What is truly groundbreaking about the study, and has enormous implications in terms of the future treatment of heart disease, said Chien, is that “the study provides a new way of understanding heart disease at it appears in children and in adults. Congenital heart disease is the most common birth defect in children worldwide, and the studies imply that congenital heart disease could be a stem cell disease.”
A number of congenital cardiac diseases appear to begin in these cells, and genes that affect the cells are known to cause heart disease in children, he added.
By identifying and manipulating the pathways along which these cells grow and differentiate, Chien said, researchers might be able to influence congenital heart disease significantly, converting severe forms of the disease to those with a better prognosis.
In adult heart disease, the major cause of morbidity is heart failure, where the implantation of human heart progenitors such as these might prove more therapeutically valuable than already differentiated heart muscle cells.
“When people think of cardiovascular regenerative medicine, they think of end stage heart failure and humans needing a transplant,” said Chien, who is director of both HSCI’s Cardiovascular Disease Program and the MGH Cardiovascular Research Center. “This study has importance for both this adult form of heart disease as well as those in children, where understanding how embryonic heart stem cells build the heart may ultimately impact therapy.”
“This is a wonderful and important study for several reasons,” said Doug Melton, co-director of HSCI. “Finding a cell that can make all the parts of the heart, including the contracting muscle, the smooth muscle and the vessels, brings us much closer to the possibility of repairing human hearts with new cells. In addition, this human progenitor cell will likely become the standard starting point for all researchers to aiming to investigate human heart development and genetic diseases of the cardiovascular system.”
Because these cardiac progenitor cells are extremely rare in the adult heart, the researchers don’t believe they play a role in the regeneration of the fully developed adult organ.
However, researchers do believe these cells have a potential role in the fetal and immediate post-natal heart to prevent congenital heart disease.
Chien’s group was particularly focused on answering the question of how the human heart expands from its small fetal size to its adult-form dimensions. “The human heart at birth is more than a thousand times bigger than the adult mouse heart, yet the size of the initial embryos are close in size. Humans are just a heck of a lot bigger than mice, and every organ is bigger. How is that achieved?”
There are two possible answers to the question:
– The first is that various independent cell lineages give rise to each of the heart structures. “The pacemaker, the valves, all these things arise, and then those cells replicate, and that replication accounts for the marked expansion,” Chien said.
– Or, the answer might be what Chien calls “a stem cell paradigm, in which a single form of progenitor cells replicate, and massively expand the pool of heart cell precursors, and then differentiate into the different structures. “The way that you could distinguish between those two possibilities,” he said, “is by looking for large numbers of those progenitors at a later stage of human cardiogenesis [in contrast with what you see in the mouse].”
To identify and track the fate of human embryonic-stem-cell-derived ISL1+ progenitors, Chien and his team genetically tagged a human embryonic stem cell line.
The researchers were then astonished that when they looked at the developing tissue they observed a heart “loaded” with progenitor ISL1+ stem cells. The biggest concentration of them was observed at a location associated with congenital heart disease, particularly in the outflow track, the aorta.
The team observed not only a large number of progenitor ISL1+ stem cells, but also distinctive intermediate cell types that give rise to all of the components of the heart.
“A stem-cell-mediated process clearly exists for expansion of the human heart, particularly in regions that are affected by congenital heart disease,” which Chen and his colleagues believe implicates heart ILS1+ stem cell progenitors in undergrowth or mal-growth of heart structures.
The team is studying three types of disease that affect children: Duchenne muscular dystrophy, specific chromosomal disorders such as DiGeorge and Down syndromes, and rare genetically based congenital heart diseases.
In each of these, Chien said, mouse models are not enough: “They are not likely to fully recapitulate the human disease.”
For Chien and his colleagues, this study also underscores the importance of continuing to use human embryonic stem (ES) cells in research, and not just induced pluripotent stem cells (iPS), which are created in the lab by forcing gene expression.
“Manipulating human ES cells genetically, by gene targeting, you can create human models of human disease directly in a simplified format, in human ES cells,” Chien said. “I think the iPS cells are going to be good for some diseases, but not all. I’m not sure they will be good for heart diseases.”
The heart cells that come out of iPS cells may not be as strong, he said.
“If you get iPS cells from a patient with congenital heart disease, what do you use as a control? Another patient?” Chien said, “The degree of variation in the iPS cell lines is significant. So how do you even compare this cell to itself? These are still early days for human heart iPS-derived cells.”
A renewable resource, ES cells may represent an alternative to adult cell-based therapy down the road, especially, said Chien, since the ability of most adult heart progenitor cells (as well as other non-heart adult cells such as bone marrow-, fat-, and endothelial-progenitor cells) to convert to authentic heart muscle over an extended period of time remains unclear.
The study was published July 1 in the journal Nature
Una terapia que utiliza células madre para reponer tejidos del corazón damnificados se ha mostrado eficiente como tratamiento auxiliar para combatir el Mal de Chagas, según una presentación hecha hoy por médicos brasileños en Río de Janeiro.
Los resultados de esta terapia, hasta ahora exitosos, fueron presentados durante el Simposio Internacional Conmemorativo del Descubrimiento del Mal de Chagas, que comenzó ayer en Río de Janeiro y se extenderá hasta el viernes.
Según el inmunólogo Ricardo Ribeiro dos Santos, investigador de la estatal brasileña Fundación Oswaldo Cruz (Fiocruz), el tratamiento experimental no ha sido 100 por ciento eficaz pero ha permitido reducir el nivel de gravedad de la enfermedad.
Las células madre fueron implantados este año en tejidos del corazón de 200 pacientes afectados por el Mal de Chagas y que ya sufren problemas cardíacos como consecuencia de la enfermedad.
La terapia está siendo experimentada como una alternativa al trasplante cardíaco, un procedimiento más delicado y que depende de la donación de un corazón con condiciones compatibles a las del paciente.
Según Dos Santos, en la mayoría de los pacientes que fueron sometidos a la terapia alternativa, el tratamiento permitió que los problemas cardíacos que estaban en los niveles 3 o 4 (los más avanzados) fueron retrocedidos hasta los niveles 1 y 2 (los menos graves).
En la investigación coordinadas por Dos Santos participan cerca de 16 instituciones brasileñas.
“Hicimos todo un trabajo experimental y constatamos que las células madre reducen la inflamación que existe en el corazón de los pacientes con Chagas,disminuyen la fibrosis, mejoran la función del corazón como bomba de sangre y mejoran los problemas que alteran los resultados del electrocardiograma”,explicó el investigador.
Según la Fiocruz, el 30 por ciento de los enfermos crónicos del Mal de Chagas sufre complicaciones cardíacas que provocan la muerte en hasta diez años.
“Los pacientes tienen conciencia que ese tipo de tratamiento no cura la enfermedad, pero que ofrece mejorías en la función cardíaca y en el estado clínico, con lo que aumenta el período de supervivencia y la calidad de vida”, afirma.
“En caso de que los resultados finales del experimento sean bastante positivos, este tipo de terapia podrá ser adoptada por el sistema de salud de Brasil y ofrecido a cerca de seis millones de personas”, agrega.
En el simposio internacional de Río de Janeiro serán presentados cerca de 300 trabajos sobre el Mal de Chagas, una enfermedad que, según la Organización Mundial de la Salud, afecta a cerca de 16 millones de personas en todo el mundo y provoca cerca de 14.000 muertes al año.
En Brasil, uno de los países que más ha avanzado en el desarrollo de tratamientos, hay 3 millones de personas ya infectadas, de las cuales 600.000 con complicaciones cardíacas o digestivas.
El simposio fue organizado para recordar al científico brasileño Carlos Chagas, que hace cien años descubrió que esta enfermedad es transmitida por el parásito Trypanosoma Cruzi a través de la picada del insecto conocido como chinche.
Transcurridos cien años de este descubrimiento aún no ha sido desarrollada ninguna vacuna que inmunice al ser humano de ese parásito ni una medicina para tratar la enfermedad con eficacia.
En: Noticias ![]()
“Las células madre de los embriones no son algo estático y tranquilo, como se pensaba hasta ahora, sino que vemos que el estado pluripotencial está dominado por fluctuaciones aleatorias y desorden”, explica Jordi García Ojalvo, que ha descubierto, en colaboración con investigadores de la Universidad de Cambridge, el circuito genético que gobierna el comportamiento de las células madre embrionarias. Este circuito es el responsable de que estas células estén siempre preparadas para poder convertirse en cualquier tipo de célula del organismo. A esteproceso se le denomina diferenciación y a la capacidad de transformarse en otros tipos de células se le denomina pluripotencialidad. “Hemos encontrado el circuito genético que gobierna este desorden y que hace que las células madre puedan responder de forma rápida y fiable a las señales que les indican en qué tipo de célula se deben convertir cuando el embrión se está desarrollando. Se trata de una manera completamente diferente de entender el estado de pluripotencialidad”, añade este investigador de la Universidad Politécnica de Cataluña en Terrassa.
En un artículo publicado en Plos Biology, los investigadores, liderados por Alfonso Martínez Arias, explican que han realizado los experimentos en ratones, para comprobar el modelo que han desarrollado del circuito genético, basado en que el desorden es una de las bases fundamentales en el funcionamiento de los seres vivos.
Lo que han encontrado es que siempre existe un subconjunto de células madre en situación de alerta, para reaccionar a las señales para la diferenciación. “Los embriones se deben desarrollar muy rápidamente, y las células madre tienen muy poco tiempo para transformarse en el tipo celular que les toque en cada momento y en cada posición. Además, lo deben hacer de una manera muy fiable y precisa, para no generar malformaciones”, asegura García Ojalvo. Él y el resto del equipo esperan que el descubrimiento, que consideran aplicable a células madre humanas, aumentará la capacidad de mantener en estado pluripotencial a las células madre embrionarias in vitro, y de inducir su transformación en todo tipo de tejidos celulares.
En: Noticias ![]()
- Un reciente informe mostraba que al menos 32 clínicas anunciaban curas con esta terapia
- Investigadores reunidos en Barcelona muestran su preocupación frente estos datos
- En el Congreso se han apuntado algunas soluciones para luchar contra este tipo de negocios
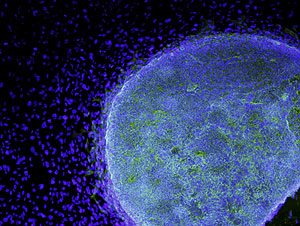 Vista microscópica de una célula madre embrionaria. (Foto: Reuters)
Vista microscópica de una célula madre embrionaria. (Foto: Reuters)MADRID.- Los impresionantes avances en el campo de las células madre han permitido a los investigadores centrarse en muy poco tiempo en resolver la cuestión de cómo pasar de las pruebas de laboratorio a los ensayos con animales y, más adelante, con humanos. Sin embargo, este contexto ha generado un problema que la comunidad científica no sabe bien cómo resolver: el turismo médico.
Algunas terapias con células madre, como algunos tratamientos cutáneos u oculares, están mostrando eficacia dentro de ensayos clínicos multicéntricos. Otras, sólo han demostrado cierta eficacia en pequeños estudios y muchas apenas ha superado los exámenes del laboratorio. Esta circunstancia no reprime, sin embargo, el instinto lucrativo de algunos que no dudan en ofrecer curas milagrosas gracias a las células madre de dudosa eficacia.
“El problema es que hay muchos pacientes que están desesperados, que no tienen otra fuente de tratamiento, que deciden correr el riesgo de acudir a estas clínicas”, ha explicado Deepak Srivastava, director del Instituto Gladstone de Enfermedad Cardiovascular, durante una conferencia de prensa ofrecida por varios expertos en la materia durante la reunión anual de la Sociedad Internacional de Investigación con Células Madre (ISSCR) celebrada estos días en Barcelona.
El turismo de células madre “nos preocupa mucho”, ha expresado Edwin M. Horwitz, del Hospital Infantil de Filadelfia (Estados Unidos). “Por eso nos comprometemos a evitarlo y nos preguntamos qué podemos hacer para proteger a los pacientes”.
Ahora bien, ¿quién le pone puertas al campo? Existen varios problemas a la hora de controlar o regular este tipo de tratamientos. En primer lugar, los expertos desconocen la envergadura del fenómeno del turismo con células madre. Algunas revistas médicas han publicado con cuentagotas casos en los que un paciente ha sido víctima de un engaño y ha recibido una terapia inocua o, en el peor de los casos, nociva. Pero el volumen de información es escaso y poco fiable.
Los especialistas sólo reciben información de forma anecdótica de algunos de sus pacientes, no es posible realizar seguimiento alguno de aquellos que deciden someterse a estas terapias y las clínicas que los ofrecen no establecen retroalimentación, ni publican estadísticas. En ausencia de estos datos, es difícil tomar medidas, sentenciaban los expertos.
Posibles soluciones
Por otro lado, existe cierta confusión acerca de quién debe regular la investigación con células madre y cómo debe afrontar este fenómeno del turismo. “Las autoridades competentes no saben cómo tratar el problema. Los países no saben cómo avanzar en su regulación”, explica Anna Veiga, del Centro de Medicina Regenerativa de Barcelona. “Lo más importante –añade- es clarificar la situación”.
Los especialistas reunidos han coincidido en la dificultad de hacer desaparecer el turismo. Ni la ISSCR tiene competencia mundial para regularlo, ni la legislación de todos los países es la misma. El fondo de la cuestión, apuntan, no es una negativa categórica sino proporcionar a los pacientes la información y las herramientas necesarias para que ellos puedan tomar una buena decisión.
A través de guías clínicas, foros en los que cada individuo pueda referir sus experiencias, establecer preguntas básicas para hacer antes de someterse a una terapia de estas características… Pero también, “debemos avanzar rápidamente para poder ofrecer opciones terapéuticas a un mayor número de pacientes”. Así, menos personas optarían por prácticas no homologadas.
En: Noticias ![]()
El gobierno federal está creando una lista maestra para identificar cuáles células embrionarias son aptas para la investigación. Esta se realizará con fondos gubernamentales al haberse levantado las restricciones. El Instituto Nacional de Salud (NIH) manifestó que sólo financiaría los proyectos con células de embriones que de otro modo serían descartadas, y no con células creadas con el propósito de efectuar una investigación. Las normas emitidas responden a una pregunta fundamental: si los nuevos requisitos descalifican a muchas de las células madre creadas durante la última década. El NIH halló una solución negociada, señalando que las viejas cepas recibirán fondos del gobierno si los científicos pueden demostrar que responden a los principios de los nuevos patrones éticos. Todos ellos serán incluidos en una lista del NIH.
“Nos parece un criterio razonable para lograr el objetivo del presidente de lograr el progreso científico y a la vez sujetarse a los patrones éticos más rigurosos”, dijo el director interino del NIH, Raynard Kington. “Creemos que es necesario aplicar el buen juicio”, agregó. El funcionario no quiso hacer conjeturas acerca de cuántas de las cepas “viejas” serían aptas, pero los científicos aprobaron el cambio.
“Preveo que la mayoría de las cepas existentes se considerarán acordes con las normas éticas”, expresó el doctor Sean Morrison, director del Centro de Biología de las células madre de la Universidad de Michigan, en Estados Unidos. “Con el tiempo, cientos de nuevas cepas de células madre estarán en condiciones de ser utilizadas”, expresó.
El experto precisó que lo que está en juego es el uso de las células madre embrionarias, que se pueden transformar en cualquier célula del organismo, con el objetivo de crear mejores tratamientos e incluso curas para una serie de afecciones, desde la enfermedad de Parkinson hasta la diabetes mellitus o lesiones de la columna vertebral.
Fuente: Washington, julio 7/2009 (AP)
En: Noticias ![]()
- Inventaron una técnica que permite desarrollar en el laboratorio espermatozoides de células madre embrionarias
LONDRES, INGLATERRA.- Un equipo británico de científicos ha marcado un hito en la ciencia al conseguir producir esperma a partir de células madre, lo que esperan que sirva para profundizar la investigación de tratamientos contra la infertilidad.
Los expertos de la universidad de Newcastle y del Instituto de Células Madre del Noreste de Inglaterra (NESCI), liderados por Karim Nayernia, inventaron una nueva técnica que permite desarrollar en el laboratorio espermatozoides de células madre embrionarias.
 Usando células madre con los cromosomas XY (masculinos), los investigadores crearon una línea germinal -las células que contienen el material genético que será transmitido a la próxima generación- a las que “ayudaron”, mediante un tratamiento con ácido, a completar la meiosis.
Usando células madre con los cromosomas XY (masculinos), los investigadores crearon una línea germinal -las células que contienen el material genético que será transmitido a la próxima generación- a las que “ayudaron”, mediante un tratamiento con ácido, a completar la meiosis.
En los seres humanos, las células de la línea o estirpe germinal se localizan en las gónadas, donde se convierten en gametos (óvulos y espermatozoides) a través de una división celular (meiosis).
Al reproducir este proceso, los expertos consiguieron producir un esperma maduro y funcional, que llamaron Esperma Derivado de In Vitro (IVD).
Sin embargo, cuando repitieron el experimento con células madre con el cromosoma XX (femenino), éstas sólo se desarrollaron en espermatogonia, y no progresaron hasta convertirse en espermatozoides maduros.
Esto demostró a los investigadores que los genes del cromosoma Y son esenciales para la meiosis y la maduración del esperma.
Ante las cuestiones éticas y morales que su descubrimiento pueda suscitar, los científicos subrayaron que este esperma IVD no será usado para crear bebés de laboratorio.
Además de estar prohibido por la ley británica, la potencial fertilización de óvulos humanos y la implantación de embriones no tendría ningún valor científico para ellos, ya que su objetivo es estudiar el proceso como un modelo para la investigación.
“Aunque podemos entender que algunas personas puedan albergar temores, esto no significa que se vayan a poder producir humanos en un plato, y no tenemos ninguna intención de hacerlo”, dijo Nayernia en declaraciones recogidas por la agencia local PA.
El estudio, publicado hoy en la revista “Stem Cells and Development”, servirá para investigar por qué algunos hombres son estériles, lo que eventualmente podría llevar a desarrollar nuevos tratamientos contra la infertilidad, añadió.
Por ejemplo, se puede investigar de qué manera las toxinas afectan a los espermatozoides en tratamientos de quimioterapia, y buscar una solución, o cómo se transmiten enfermedades genéticas, y también averiguar si el esperma IVD podría ser útil eventualmente en tratamientos de fertilidad, para permitir que hombres estériles pudieran tener hijos con su código genético.
En todo caso, Nayernia advirtió de que, dada la velocidad a la que evoluciona la ciencia en este campo, los Gobiernos deberían introducir cuanto antes legislación para regular su aplicación
En: Noticias ![]()
El tratamiento combate la inflamación neuronal de los animales que han desarrollado la enfermedad.
LEVANTE-EMVV VALENCIA
Un equipo del Centro de Investigación Príncipe Felipe (CIPF) y de la Universitat de València han demostrado que la inyección de células madre neuronales del cerebro protege ante la inflamación que aparece en modelos animales de esclerosis múltiple, promoviendo la recuperación.
El descubrimiento del Laboratorio de Morfología Celular supone un “paso más” en la aplicación de las células madre adultas para el tratamiento futuro de la enfermedad y propone un mecanismo terapéutico de sustitución de las células dañadas.
El hallazgo se ha llevado a cabo dentro de un proyecto de colaboración internacional con equipos de Milán, Roma y Porto. El estudio se ha publicado en PLoS ONE.
La esclerosis múltiple es una enfermedad neurodegenerativa para la cual no existe tratamiento curativo en la actualidad. En ella, la mielina -una envoltura que recubre las fibras nerviosas- se daña y las neuronas pierden la capacidad de transmisión, los impulsos nerviosos se ralentizan o no llegan a transmitirse, por lo que se vinterrumpe la capacidad de conducir las órdenes del cerebro
En: Noticias ![]()





